Atoom
Dåt atoom as en submikroskoopisch struktuur, ju önj åle gewöönlik mateerii forkamt. Atoome bestönje üt subatoomische diile: elektroone, protoone än neutroone. Atoome heewe jü draft, ja tu kombiniiren am moleküüle tu bilen. En wåådermoleküül tun biispel bestoont üt tou wååderstufatoome än iinj sörstufatoom. Atoome san da fundamentäle bägstiine foon e kemii än da wårde önj keemische reaksjoone uler tunintemååged. Dåt jeeft bloot 91 tüüpe foon chemische bägstiine unti keemische elemänte, da önj e natuur aw e jard fünen wårde. Ja wårde klasifisiird önj e perioodisch tabäle. Jü klasifikasjoon as grünlaid aw e tål protoone önj dåt atoom. Ouer tüüpe atoome koone künstlik mååged wårde, ouers da san ai stabiil än breege åläiwen ouf eefter natüürlike keemische elemänte döör kärnkliiwing.
Atoome foon dåtseelwie elemänt koonen ferschilie radioaktiiwe äinschape hääwe, grünlaid aw e tål neutroone önj e kärn. Atoome mad jüseelwie tål protoone, ouers ünlike tåle neutroone, wårde isotoope foon dåtseelwie keemische elemänt nååmd. Ouerdåt atoome ålewäägens forkaame, san da ål iirhunerte lung fälj foon stuudium. Nütutids ruchte da unersäkinge jam forålem aw kwantum-efäkte, ås önj Bose-Einstein-kondensaat.
Atoomteorii
[Bewerke | Kweltekst bewerke]Jü atoomteorii as en teorii ouer dåt weesen foon e mateeri. Jü teorii säit, dåt åle mateeri üt atoome bestoont.
Da griichische filosoofe, ås Leucippus än Democritus, hääwe ouer dåt weesen foon e mateeri eeftertoocht. Jare tånken heet, iinjfåch säid, diheere wäi fülied: Wan en materjool ås tun biispel gölj apbräägen wårt, änret dåt weesen foon da latje stöögne ham ai - dåt as nuch åltens gölj. Da griiche hääwe spikeliird dåt, wan da stöögne önj nuch latjere stöögne apbräägen wårde, deer wårschiinjlik en ståådium kamt, weer da latje diile ai wider apbråågen wårde koone. Önj dåt griichische bedjüset dåt uurd “atomos” ‘ai schiisbor’. Dåt as weer dåt uurd ‘atoom’ jurt kamt.
Struktuur
[Bewerke | Kweltekst bewerke]Sub-atoomische partiikle
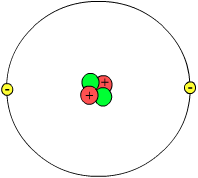
[Bewerke | Kweltekst bewerke]Atoome bestönje önj e hoodsååge üt lääsie rüm, ouers uk üt latje subatoomische diile. Made önj dåt atoom as en latje positiiw lååsenen kärn, wat bestoont üt nukleoone, ås huum da protoone än neutroone tuhuup namt. Di räst foon dåt atoom bestoont üt da smiisie eläktrooneschaale. Deerbai heet en proton en positiiw eläktrisch lees än en eläktron en lik grut negatiiw lees. Önj en neutråål atoom as deerfor jü tål protoone än eläktroone lik än san da lääse iinjenouder ütwäägen.
Lääsene atoome wårde ioone nååmd. Atoome ma maner eläktroone ås protoone hääwe en positiiw lees än san bekånd ås katioone. Deer ouerfor hääwe atoome ma mör eläktroone ås protoene en negatiiw lees än da wårde ås anioone betiikned.
Elektroone draie trinam di kärn ma grut gauihädj. Ja draie uk önj ferschilie oustånde foon di kärn. Huum säit, dåt da näiste bai di kärn kaame önj iinj schaal for än da wider wäch san önj wi en ouder schaal. Ark schaal fäit en numer: dåt näist bai di kärn as schaal 1, jü füliend foon di kärn ouf räägned wårt schaal 2 nååmd, äsw. Di kärn as mör åas 100.000 keere latjer ås dåt atoom; jü grute foon dåt atoom wårt ålsü bestimd döör jü grute foon jü büterst eläktrooneschaal. Wan we en atoom fergrutere wörden tu jü grute foon hiilj Nordfraschlönj, dan wus di kärn deer made önj nuch latjer ås sün latjen golfbååle!
Elemänte än isotoope
[Bewerke | Kweltekst bewerke]Atoome wårde gewöönlik klasifisiird eefter jare Atoomtåle, da stime tu jü tål protoone önj dåt atoom (önj neutroole atoome as dåt lik an jü tål eläktroone). Jü atoomtål bestimt jü famiili unti dåt elemänt, weer dåt atoom tu hiirt. Koolestuf-atoome san tun biispel da iinjsiste atoome, da 6 protoone önjthüülje. Ål da atoome ma jüseelew atoomtål diile en wid ferschilihäid foon füüsische äinschape än ferhüülje ja keemisch lik. Da ferschilie tüüpe atoome wårde önj jü perioodisch tabäle betiikned. Ju masetål unti nukleontål teelt da gånse protoone än neutroone, da önj dåt atoom forkaame. Jü tål neutroone heet nån influs aw e elemäntklasifikasjoon foon en atoom. En keemisch elemänt as ålsü en hiilj ‘atoomfamiili’ än deerönj koone ålsü ünlike atoomtüüpe forkaame, da jüseelew atoomtål hääwe, ouers ünlike masetåle. Da atoomtüüpe wårde dan isotoope foonenouder nååmd.
Am en isotoop foon en ouder isotop önj sin elemäntfamiili tu unerschiisen, schraft huum ääder di noome foon en elemänt sin masentål, t.b. koolestuf 14 (wat bestoont üt 6 protoone än 8 neutroone önj ark atoom}.
Dåt iinjfåchst atoom as dåt wååderstuf-atoom, ma atoomtål foon 1 än wat bestoont üt en proton än en eläktron. Di wååderstuf-isotoop di 1 neutron äkstra önjthüüljt, wårt deuterium nååmd, än di wååderstuf-atoom ma tou äkstra neutroone håt tritium. Da isotoope wjarn en teemå, wat rucht intråse önj e waasenschap apteeld heet, forålem önj e eeder önjtwikling foon e kwantenteorii.
Büterste schaale än ferbininge
[Bewerke | Kweltekst bewerke]Dåt keemisch ferhüüljen foon atoome as önj e hoodsååge tu tunken an e interaksjoon twasche jare eläktroone. Forålem da eläktroone önj e büterst schaal, da faläns-eläktroone nååmd wårde, hääbe di grutste influs aw dåt keemisch ferhüüljen. Kärnelektroone (da, da ai önj e büterst schaal forkaame) spaale wälj en sekundäär rule, önj e hoodsååge ouer dåt oufschirmingsefäkt foon e positiif lees önj di atoomkärn.
Ark schaal trinam di kärn koon bloot en bestimde tål elektroone bärje:
Schaal 1: - 2 eläktroone
Schaal 2: - 8 eläktroone
Schaal 3: - 8 of 18 eläktroone (oufhingi foon dät elemänt weer ham dåt am hoonlet)
Ark atoom, wat en ful (unti lääsi) büterst schaal heet, as mör stabiil. Atoome linge jü stabilitäät döör eläktroone tu diilen ma näiber-eläktroone unti döör eläktroone foon oudere atoome hiiljenåål wächtuhåålen. Wan eläktroone diiljd wårde, wårt en koofalänt ferbining biled.
Koofalänte ferbininge san da starkste atoomische ferbininge. Aw jüdeer wise bliwe atoome tuhuup önj grupe, da moleküüle nååmd wårde. Da eläktroone önj e büterst schaal draie dan trinam åle atoome tou, wät älk individuäl atoom dan leet ma en ful (ålsü stabiil) büterst schaal.
Wan iinj unti möre eläktroone gåns foon en atoom wächhülen wårde döör en ouder atoom, dan wårt en ion bilied. Ioone san atoome, da en näto-lees hääwe, infüli foon dåt ünlikwächt önj tål protoone än eläktroone. Hu atoome, ås natrium, hääwe mån iinj eläktron önj e büterst schaal.
Oudere, ås kloor, brüke jüst mån iinj eläktron, am e büterst schaal fultumåågen. Wan natrium-atoome kontakt mååge ma kloor-atoome, dan jeeft ark natrium-atoom sin büterst eläktron ouf tu en kloor-atoom. Da natrium-atoome foue dan en positiiw lees än da kloor-atoome en negatiiw lees. Dåt ion wat dåt eläktron ‘steelen’ heet, wårt dåt anion nååmd än as negatiiw lääsen. Deeriinj wårt dåt atoom wat sin eläktron ferlääsen heet, en kation nååmd än as positiiw lååsen. Katione än anione wårde eefternouder tu täägen infüli foon da Coulombkrafte twasche da positiiwe än negatiiwe lååse. Jü önjtiikraft wårt elektrovalänte unti ioonische kraft nååmd än as swåker ås koofalänte ferbininge.
Sii uk
[Bewerke | Kweltekst bewerke]| Didiar artiikel as di 1. Jüüle 2012 uun det list faan gud artiikler, diar det leesen luane apnimen wurden. Uun uugenblak jaft at diar 73 faan. |
